Einige Bakterien und Blaualgen reduzieren atmosphärischen Stickstoff zu Ammoniak, und einige dieser Arten wiederum leben in Symbiose oder Assoziation mit grünen Pflanzen. Am bekanntesten sind die Knöllchenbakterien (Rhizobien) der Leguminosen. Sie sind wirtsspezifisch. Rhizobium japonicum lebt in Symbiose mit der Sojabohne, Rhizobium trifolii mit Klee und Rhizobium meliloti mit Luzerne; Anabaena azollae (eine Blaualge) kooperiert mit dem Wasserfarn Azolla, und Nostoc muscorum (ebenfalls eine Blaualge) mit der Tropenpflanze Gunnera macrophylla. In der Leguminosengattung Pisum gibt es Arten, die ständig in Symbiose mit Knöllchenbakterien leben, andere, die funktionslose Knöllchen bilden, und schließlich solche, die keine Knöllchen bilden und daher zu keiner Symbiose befähigt sind.
Zu den stickstoffreduzierenden (stickstoffbindenden, stickstoffixierenden) Arten gehören eine Anzahl freilebender Bodenbakterien z.B. solche aus den Gattungen Azotobacter (aerob lebend), Closterium (strikt anaerob), Klebsiella (fakultativ aerob) und Rhodospirillum (anaerob, mit Photosynthese).
In den beiden letzten Jahrzehnten ist viel über Stickstoffixierung gearbeitet worden, weil man sich durch Einsatz gentechnischer Verfahren eine Verbesserung der Stickstoffversorgung der Pflanzen erhoffte. Die Produktion von synthetischem Stickstoffdünger ist nämlich kostspielig und außerordentlich energieaufwendig. Doch auch die Bakterien schaffen es nicht, energiesparend Ammoniak zu bilden. Die Dreifachbindung des Stickstoffs gehört nämlich zu den stärksten kovalenten Bindungen in biologisch wichtigen Molekülen. Für die Umsetzung von 1 Mol Stickstoff zu 2 Mol Ammoniak werden 25 Mol ATP benötigt, oder anders ausgedrückt, pro Gramm fixiertem Stickstoff werden - unter günstigsten Voraussetzungen - ca. 10 g Glucose verbraucht. Besonders aufwendig ist die Reaktion in Azotobacter, denn dort werden sogar ca. 100 g Glucose benötigt.
Trotz dieser Handicaps sind die genetischen Grundlagen der Stickstoffixierung weitgehend geklärt. Das bevorzugte Versuchsobjekt war und ist Klebsiella pneumoniae, ein Enterobakterium aus der Verwandtschaft von Escherichia coli und den Salmonellen. Eine Schlüsselstellung kommt dabei dem Nitrogenasekomplex zu. Die Codierung und die Regulation dieses Proteins erfolgt durch einen DNS-Abschnitt (nif-Region), der bei Klebsiella 16 (-17?) Gene umfaßt. Die nif-Gene gehören sieben Operons (Transkriptionseinheiten) an. Von einem der Gene abgesehen, liegen alle auf einem (dem "codierenden") DNS-Strang, das eine liegt auf dem dazu komplementären.
Monitrogenase component I - in reduzierter und oxydierter Form (obere Bildreihe) - Die Biologische Stickstoff-Fixierung, d. h. die Reduktion molekularen Stickstoffs zu Ammoniak, wird durch den Nitrogenase - Enzymkomplex (EC 1.18.6.1) katalysiert. Die Nitrogenase (MoNitrogenase), die in allen Stickstoff-bindenden Organismen vorkommt, besteht aus zwei Teilen: Komponente I [Nitrogenase Molybdän-Eisen (MoFe) Protein, bzw. Dinitrogenase], und Komponente II [Nitrogenase Eisen (Fe) Protein, bzw. Dinitrogenase Reduktase] © PROMISE
Bei Azotobacter sind die Gene über das Gesamtgenom verstreut. Die nif-Region aus Klebsiella ist isoliert und auf Plasmide überführt worden. In damit transformierten Escherichia coli-Zellen wird sie exprimiert. Doch einer Übertragung der nif-Region ins Genom grüner Pflanzen stehen einige prinzipielle Schwierigkeiten im Wege:
müßte man die Gene an Eukaryotenpromotoren koppeln, um eine Genexpression zu erwirken,
müßten sauerstofffreie Kompartimente oder Zonen geschaffen werden, denn die Nitrogenase ist extrem sauerstoffempfindlich,
müßten die Elektronentransportketten der Pflanzenzellen mit denen der Nitrogenase abgeglichen werden, und
schließlich, müßten ausreichende Mengen an ATP bereitgestellt werden.
Es geht also gar nicht so sehr darum, die Gene auf gentechnischem Wege ins Pflanzengenom einzuschleusen als vielmehr darum, ihre Expression und die Aktivität der Genprodukte in den Griff zu bekommen. Zu diesem Problemkreis liegen bislang keinerlei praktikable Lösungsvorschläge vor. Man ist daher eher darum bemüht, die Effizienz von Bodenbakterien zu steigern oder die Bedingungen im Rhizosphärenbereich der Pflanzen zu optimieren.
Soweit Bakteriologie, welchen Beitrag leisten nun aber die Pflanzenarten, die zu einer Symbiose mit stickstoffbindenden Bakterien prädestiniert sind? Dazu die folgenden Teilprobleme:
- Wie kommt die Interaktion - Erkennung - zwischen Bakterium und Pflanzenwurzel zustande?
- Wie erfolgt die Infektion, d.h., wie dringt das Bakterium in die Pflanzenzellen ein?
- Welche pflanzlichen Gene werden nach der Infektion aktiviert?
- Welche Veränderungen gehen im Bakterium vor sich?
- Wie wird das von den Bakterien produzierte Ammoniak verwertet?
Es ist bekannt, daß an den meisten Zelloberflächen Kohlenhydrate (Oligosaccharide) exponiert sind, und es lag daher nahe, zu untersuchen, ob das Kohlenhydratmuster an den bakteriellen Oberflächen und an den Oberflächen von Wurzelhaaren an einer Interaktion beteiligt sind. Man weiß zudem, daß Pflanzen kohlenhydratbindende Proteine (Lektine) produzieren, die hier als verbindende Elemente (Kuppler) mitwirken könnten. Die skizzierte Modellvorstellung konnte durch gezielte Experimente verifiziert werden. F. B. DAZZO und D. H. HUBBELL (Michigan State University) wiesen 1975 nach, daß Trifolium repens (Weißklee) ein bestimmtes Lektin (Trifolin) mit einer Afflnität zu 2-Desoxyglucose sezerniert und daß dieser Zucker sowohl an der Oberfläche von Rhizobium trifolii als auch an der von Wurzelhaaren von Trifolium-Arten vorkommt. Es gibt Rhizobium-trifolii-Mutanten, denen er fehlt. Sie sind nicht in der Lage, Klee zu infizieren und eine Knöllchenbildung zu induzieren.
Rhizobium japonicum zeichnet sich durch exponierte Galactosylreste aus. Das Lektin der Wirtspflanze, das Sojabohnenagglutinin (SBA), ist galactosespezifisch.
Rhizobien sind beweglich, sie reagieren chemotaktisch und gelangen somit in die Rhizosphäre ihrer Wirtspflanzen. Als Signalmoleküle dienen von den Wurzeln ausgeschiedene Phenole, wie z.B. das Luteolin und als Reaktion darauf wird im Bakterium das NodD Gen aktiviert, das einen regulatorischen Einfluß auf weitere Gene ("nod-Box": NodA, NodB, NodC) ausübt. Diese Gene kommen bei allen Rhizobien vor (common nod-genes), eine weitere Gruppe von Nod-Genen (NodH ...) ist an der Spezifität der Reaktion zwischen Bakterium und Wirtspflanze beteiligt. Nach Bildung eines weiteren Signalmoleküls kommt es zu der ersten sichtbaren morphologischen Veränderung: die Wurzelhaare krümmen sich ein.
Bakterien aus der Gattung Bradyrhizobium verfügen über ein Zweikomponentensystem: NodV und NodW, auch hier geht man davon aus, daß beide für die Initiation der Nodulation (Knöllchenbildung) benötigt weren. Außer den Nod-Genen kennt man auch eine Gruppe von Genen mit der Bezeichnung hsn (host specifisity of nodulation), von denen gezeigt werden konnte, daß sie nur innerhalb der eigenen Art wirksam sind; sie können einen entsprechenden genetischen Defekt bei einer andern Bakterienart nicht komplementieren.
Außer den genannten Nod-Genen fanden LEROUGE et al. (1990), daß Rhizobium meliloti (das eine Symbiose mit der Luzerne eingeht) ein weiteres hochspezifisches Molekül, NodRm-1 produziert, das offensichtlich ein direkter Auslöser der Wurzelhaardeformation ist. Die Struktur von NodRm-1 ist neuartig. Es ist ein (beta)-verknüpftes Glucosamin-Tetrasaccharid. Drei der vier Zuckergruppen sind N-acetyliert, am reduzierenden Ende sitzt eine Sulfatgruppe und am nicht-reduzierenden Ende trägt es eine N-Acetyl-C16-Fettsäure. Dieses Molekül gleicht keinem der bekannten intrazellulären Phytohormone oder anderen Regulatormolekülen. Interessant ist diese Beobachtung insofern, als daß den Oligosacchariden (Oligosaccharinen) in letzter Zeit besondere Aufmerksamkeit geschenkt wurde, weil gezeigt werden konnte, daß ganz bestimmte Vertreter dieser Molekülklasse an der spezifischen Interaktion zwischen Pflanzen und Pilzen beteiligt sind und daß sie als Regulatoren von Differenzierungsprozessen wirken.
Die Infektion durch Rhizobium induziert Knöllchenbildung. Die Synthese von zwei pflanzlichen Proteinen ist dabei bemerkenswert: Nodulin und Leghämoglobin. Das Nodulin bewirkt eine Vergrößerung und Vervielfachung der Rindenzellen. Der Ploidiegrad der Kerne nimmt dabei zu. Wie die Kausalkette im einzelnen aussieht, ist allerdings weniger gut bekannt. Es ist deshalb auch nicht entschieden, ob die Vergrößerung der Zellen die Folge der Polyploidie ist oder ob sie auf direktem Nodulineinfluß beruht. Das Wurzelknöllchengewebe ist blutrot gefärbt. Es enthält Leghämoglobin, das den Hämoglobinen tierischer Zellen homolog ist. Die Aminosäuresequenzen sind ähnlich, die Tertiärstrukturen sind weitgehend identisch. Diese Feststellungen führten zu der Annahme, daß es Globingene schon gab, bevor sich die Stammeslinien von Pflanzen und Tieren trennten. Es müßten daher sehr alte Gene sein, und man fragte sich, weshalb sie im Pflanzenreich nur sporadisch exprimiert sind.
Die DNS-Analyse ergab, daß das Leghämoglobingen vier Exons enthält, Hämoglobingene nur drei (M. GO, 1981). Das wiederum weist darauf hin, daß die Teilabschnitte üblicherweise wohl getrennt vorliegen und als solche nicht exprimierbar sind. Nur wenn sie - durch Translokation - zu einer Transkriptionseinheit zusammengeschlossen werden, erfolgt eine Hämoglobin-, respektive Leghämoglobinbildung. Dieses Ereignis trat im Pflanzenreich bei den Leguminosen, und wie man auch weiß (C. A. APPLEBY et al., 1983), bei einer den Ulmen nahestehen den Art (Parasponia rigida) aus dem Malaiischen Archipel auf. Hier jedoch sind, wie bei den Hämoglobinen der Tiere, nur drei Exons vorhanden. Inzwischen wurden Hämoglobine in rund einem Dutzend verschiedener, nicht-verwandter Pflanzenfamilien nachgewiesen. Zu klären bleibt, welche Funktion den Hämoglobinen bei diesen Pflanzenarten zukommt.
Während die Proteinkomponente des Leghämoglobins durch das pflanzliche Genom codiert wird, erfolgt die Bildung des Porphyrinrings im Bakterioid. An dessen Synthese sind folglich bakterielle Gene beteiligt, und deren Aktivität muß mit der der pflanzlichen Globingene synchronisiert sein. Das zentrale Eisenion wiederum wird von den Pflanzenzellen beigesteuert. Die Bakterioiden haben einen hohen Bedarf daran, ebenso wie an Molybdän-Ionen, denn beide zusammen sind für die Aktivität der Nitrogenase essentiell. Dieses Enzym ist sauerstoffempfindlich. Leghämoglobin bindet Sauerstoff und kann daher sauerstoffarme Räume im Wurzelbereich der Pflanzen schaffen, in denen sich dann die Nitrogenaseaktivität der Bakterien entfalten kann.
Auch die Bakterien verändern sich. Sie werden zu Bakterioiden, denen die äußere Membran fehlt. Die Zellen verzweigen sich; mit zunehmendem Alter nimmt der Verzweigungsgrad zu.
Durch die Aktivität der Nitrogenase entsteht Ammoniak, ein schweres Zellgift, das von den Bakterien an die Pflanzenzellen abgegeben wird.
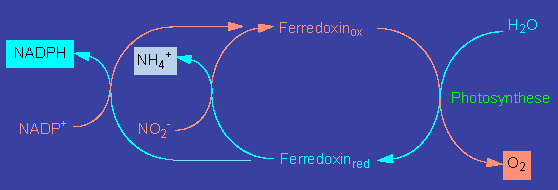
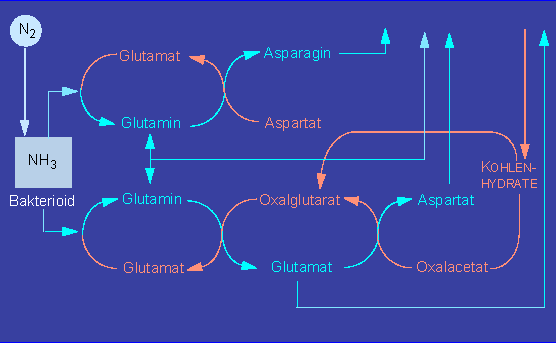
Die dabei beteiligten pflanzlichen Enzyme sind die Glutamatdehydrogenase, die Glutaminsynthetase und die Glutamatsynthetase. In allen drei Fällen müssen von der Pflanzenseite her genügende Mengen an Kohlenstoffskeletten (Akzeptoren) bereitgestellt werden.
So wichtig die gerade besprochenen Beiträge der symbiotisch lebenden Bakterien für die Stickstoffversorgung der Pflanzen auch sind, so gering ist ihr Anteil am Gesamtstickstoffhaushalt in der Natur. Die Menge angebauter Leguminosen beträgt weniger als 10 Prozent der Menge aller Kulturpflanzen; den Hauptanteil machen die Getreidearten aus. Bei einigen Arten, z.B. beim Zuckerrohr und beim Reis, ist eine Häufung stickstoffbindender Bakterien im wurzelnahen Bereich (Rhizosphäre) nachgewiesen worden. Zu den bedeutendsten Sekretionsprodukten vieler Pflanzenwurzeln gehören Kohlenhydrate (bis zu 20 Prozent der durch Photosynthese gewonnenen Menge); diese können von den Bakterien als Energiequelle und als Akzeptoren für Ammoniak verwendet werden.
In einigen Fällen, z.B. bei Spartina alternifolia, einigen Reissorten u.a., dringen die Bakterien in die Interzellularen des Wurzelgewebes ein. Besonders gut funktioniert die Kooperation mit C4-Pflanzen, doch auch einige C3-Pflanzen beherbergen Bakterien.
Azospirillum brasiliense, das fast nur mit C3-Pflanzen assoziiert ist, ist auf die Versorgung mit organischen Säuren, vornehmlich Malat, angewiesen. Über den Stickstoffgewinn beim Anbau von Gramineen liegen quantitative Daten vor. Eines geht klar daraus hervor: die höchsten Gewinne werden in den Tropen erzielt.
Die Wechselwirkungen in Anabaena-Azolla-Symbiosen unterscheiden sich von den Leguminosen-Rhizobien-Interaktionen. Über die Erkennungsreaktion ist nur wenig bekannt. Anabaena dringt an der Spitze wachsender Sprosse in das Gewebe des Farns ein. Die Stickstoffixierung erfolgt in differenzierten (spezialisierten) Zellen, den Heterozysten, die im Wechsel mit vegetativen, photosyntheseaktiven Zellen entlang eines Algenfilaments auftreten. Größenordnungsmäßig ist etwa jede zehnte Zelle ein Heterozyst. Im Falle der Anabaena-Azolla-Interaktion sind eindringende Anabaena-Zellen klein, Heterozysten fehlen. Erst nachdem sie das Farngewebe kolonisiert und sich in intrazellulären Kavernen eingenistet haben, setzen Heterozystenbildung und damit Stickstoffixierung ein (H. D. HILL, 1977). Azolla ist in den Reisfeldern Ostasiens verbreitet, wo ein beachtlicher Teil des von ihm gebundenen Stickstoffs den Reispflanzen zugute kommt.
Bei symbiontischen und bei freilebenden Anabaenen (und anderen Blaualgen) stellt sich die Frage nach dem Schutz vor Sauerstoff. Einerseits gibt es intrazelluläre Stoffwechselprozesse, die überschüssigen Sauerstoff abfangen, andererseits ist aber auch beobachtet worden, daß Heterozysten oft von Bakterien umgeben sind. Aktive Heterozysten sind, im Gegensatz zu den vegetativen Zellen, von einem Polysaccharidmantel umgeben, und der wiederum scheint den Bakterien als Nahrung zu dienen; sie verbrauchen durch ihren eigenen Stoffwechsel Sauerstoff und schaffen damit um die Heterozysten herum sauerstoffarme Mikrozonen.
|
|